超深度磷酸化蛋白组学用于蛋白激酶抑制剂选择性评价
发布时间:2025-08-27 16:33 | 点击次数:169
蛋白磷酸化是真核细胞最普遍的翻译后修饰形式,在细胞信号转导,细胞过程以及蛋白质功能调控方面发挥着重要作用。蛋白磷酸化是通过蛋白激酶将三磷酸腺苷(ATP)末端磷酸基团转移到底物蛋白的丝氨酸、苏氨酸和酪氨酸残基上。蛋白激酶的基因突变或异常表达引起激酶过度激活,从而引发癌症及其他疾病。因此,蛋白激酶已成为最重要的抗肿瘤药物靶点之一。目前,全球有80余种激酶抑制剂(PKI)获批上市,还有约180种PKI正在进行临床试验。尽管如此,PKI药物的研发仍面临诸多挑战,特别是靶点选择性以及脱靶毒性。目前,PKI的选择性评价主要依赖于数百种克隆纯化的蛋白激酶,或转基因高表达目标激酶的细胞系。纯化的激酶因脱离细胞环境,无法真实反映PKI在细胞内的选择性;而转基因细胞的测试仅限于预先设定的目标激酶。针对这一问题,中国科学院上海有机化学研究所生命过程小分子调控全国重点实验室康经武课题组发展了一种超深度磷酸化蛋白质组学方法,实现了在细胞水平和蛋白组学层面对PKI选择性的全面评价。
蛋白磷酸化具有高度动态和低丰度的特点(磷酸化蛋白质组仅占总蛋白质组的0.1%,而酪氨酸磷酸化蛋白仅占磷酸化蛋白质组的 0.1-1%),因此,磷酸化肽段的富集成为质谱分析的关键步骤。为了精确测量PKI引起的磷酸化事件,在他们发展的系列微型整体亲和色谱柱技术的基础上(Anal Chem 2020,92,3913-3922,J Proteome Res 2023,22,2450-2459,Anal. Chem. 2023, 95, 8605-8612),提出了一种集成三种选择性互补的磷酸化肽段富集材料的策略,实现了对磷酸化肽段的深度全覆盖和无偏倚的定量分析(图1)。
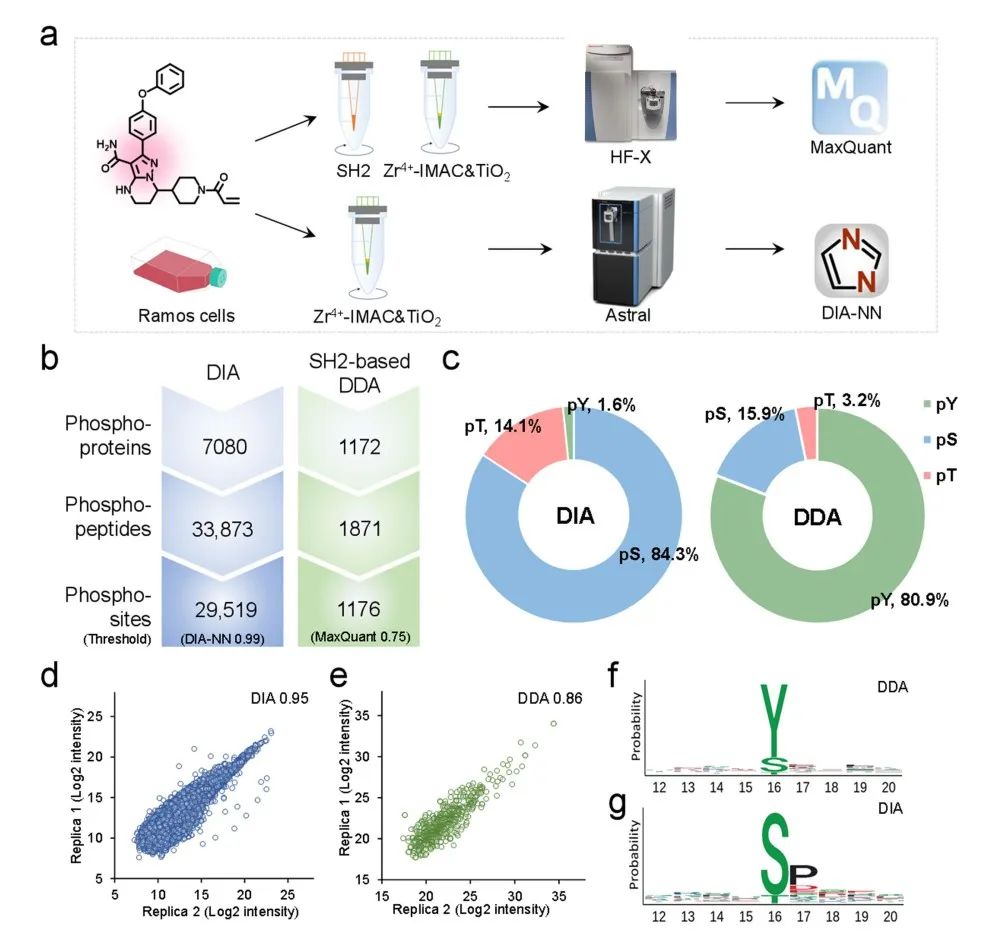
图1. 超深度磷酸化蛋白组分析流程示意图和磷酸化蛋白组分析数据轮廓
以泽布替尼为模型,在数据依赖性质谱采集(DDA)数据中,检测到25种蛋白质的25个磷酸化位点的磷酸化水平显著上调,66种蛋白质的72个磷酸化位点的磷酸化水平显著下调(其中酪氨酸磷酸化占比为80.9%);在数据非依赖性质谱采集(DIA)数据中,检测到有80种蛋白质的91个磷酸化位点的磷酸化水平显著上调,167种蛋白质的的磷酸化水平显著下调(绝大部分为丝氨酸/苏氨酸磷酸化位点)(图2)。
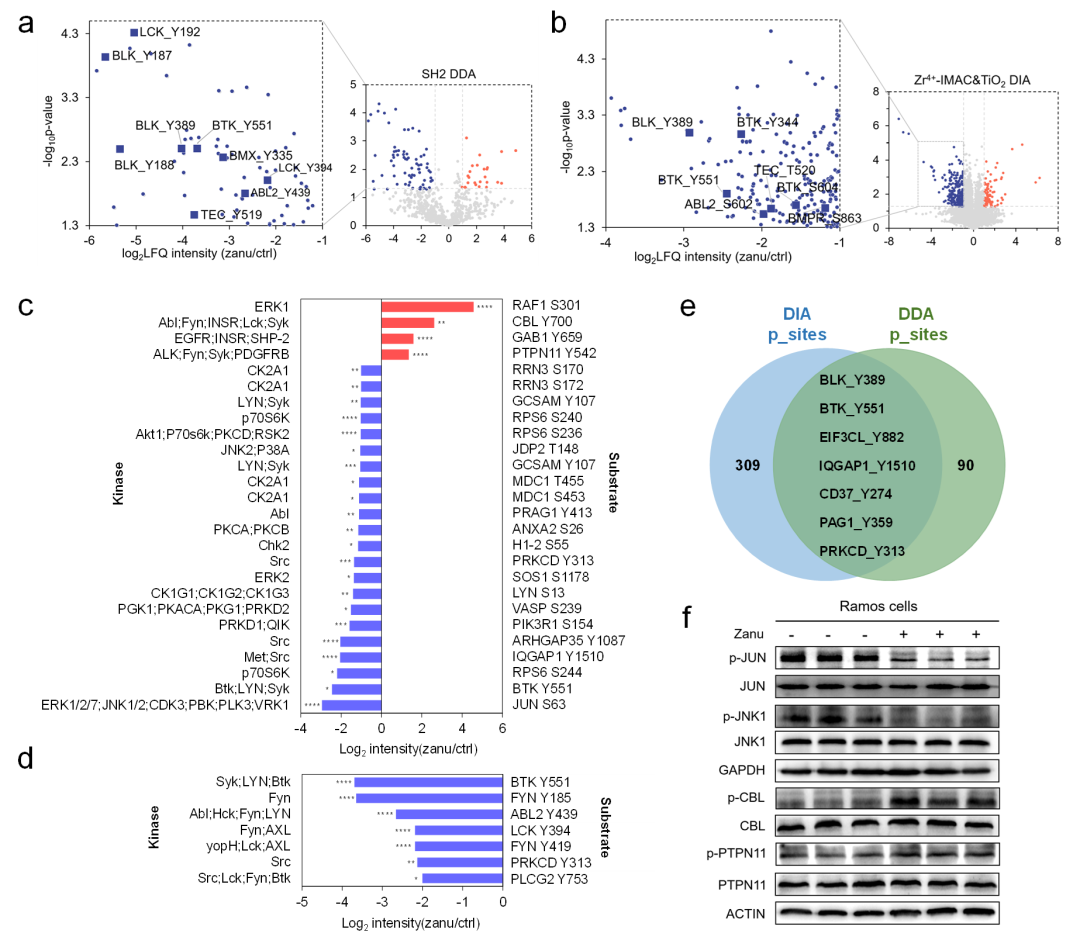
图2. 超深度磷酸化蛋白组学分析揭示泽布替尼引起的B细胞淋巴瘤细胞的磷酸化事件变化
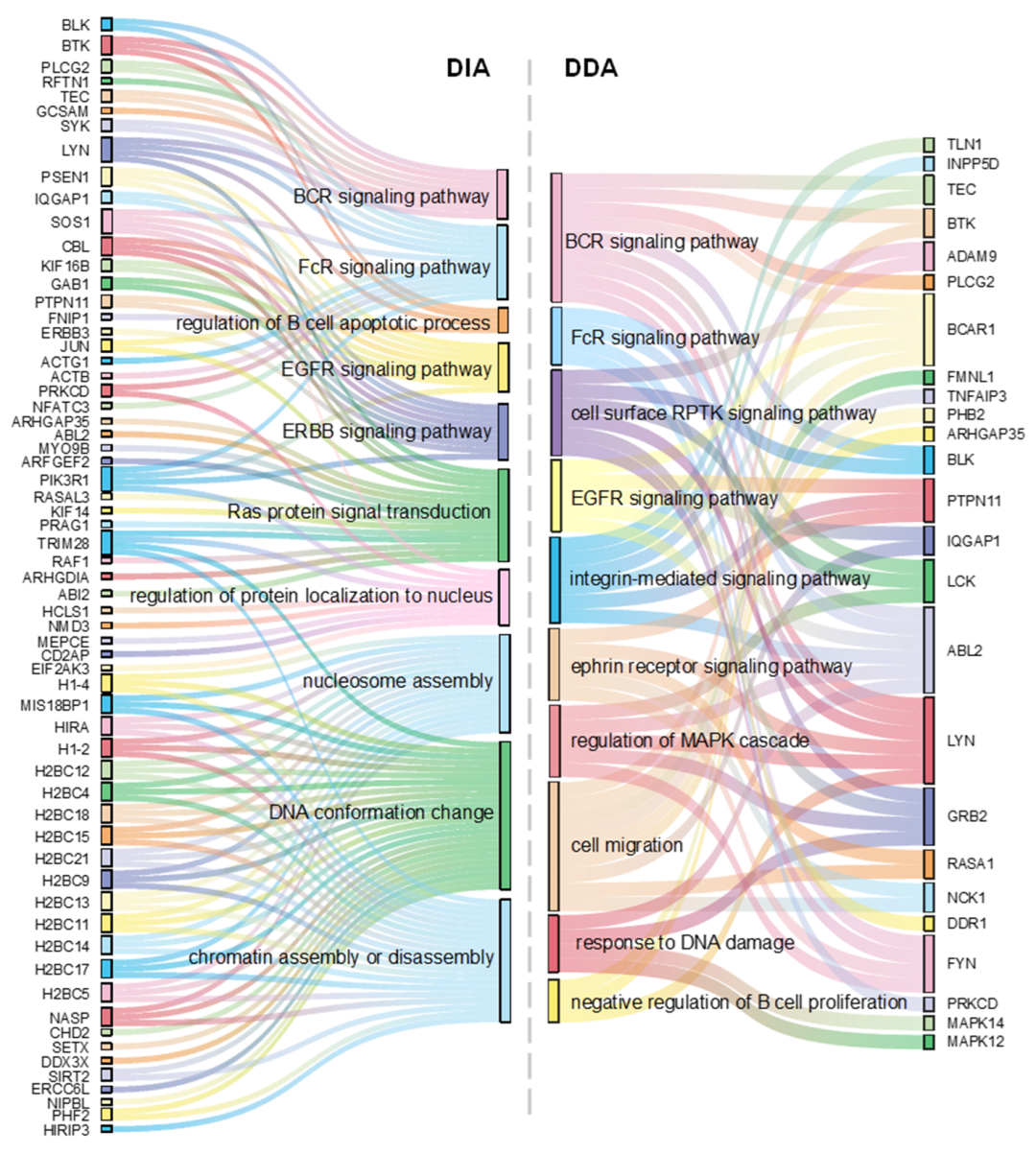
图3.泽布替尼抑制或激活的蛋白激酶及其参与的细胞过程
生物信息学富集分析表明,除了抑制BCR和FcR信号通路外,泽布替尼还调控了B细胞凋亡、EGFR、ERBB、RPTK以及MAPK级联等信号通路(图3)。非常有意思的是,他们的研究发现泽布替尼不仅抑制了BTK及其下游多个关键的信号通路,还上调了RAF1、CBL和PTPN11蛋白的磷酸化水平,进而激活了ERK1/2 MAPK介导的BCR信号通路负反馈调控,在BCR信号通路上游阻断信号转导。与文献报道的泽布替尼的靶点相比,他们发展的超深度的磷酸化蛋白组学策略能够在活细胞水平,以高通量的方式获得更丰富的作用靶标(或脱靶)信息。通过将磷酸化事件映射到细胞信号通路中,可以全景式地揭示泽布替尼的作用机制(图4)。
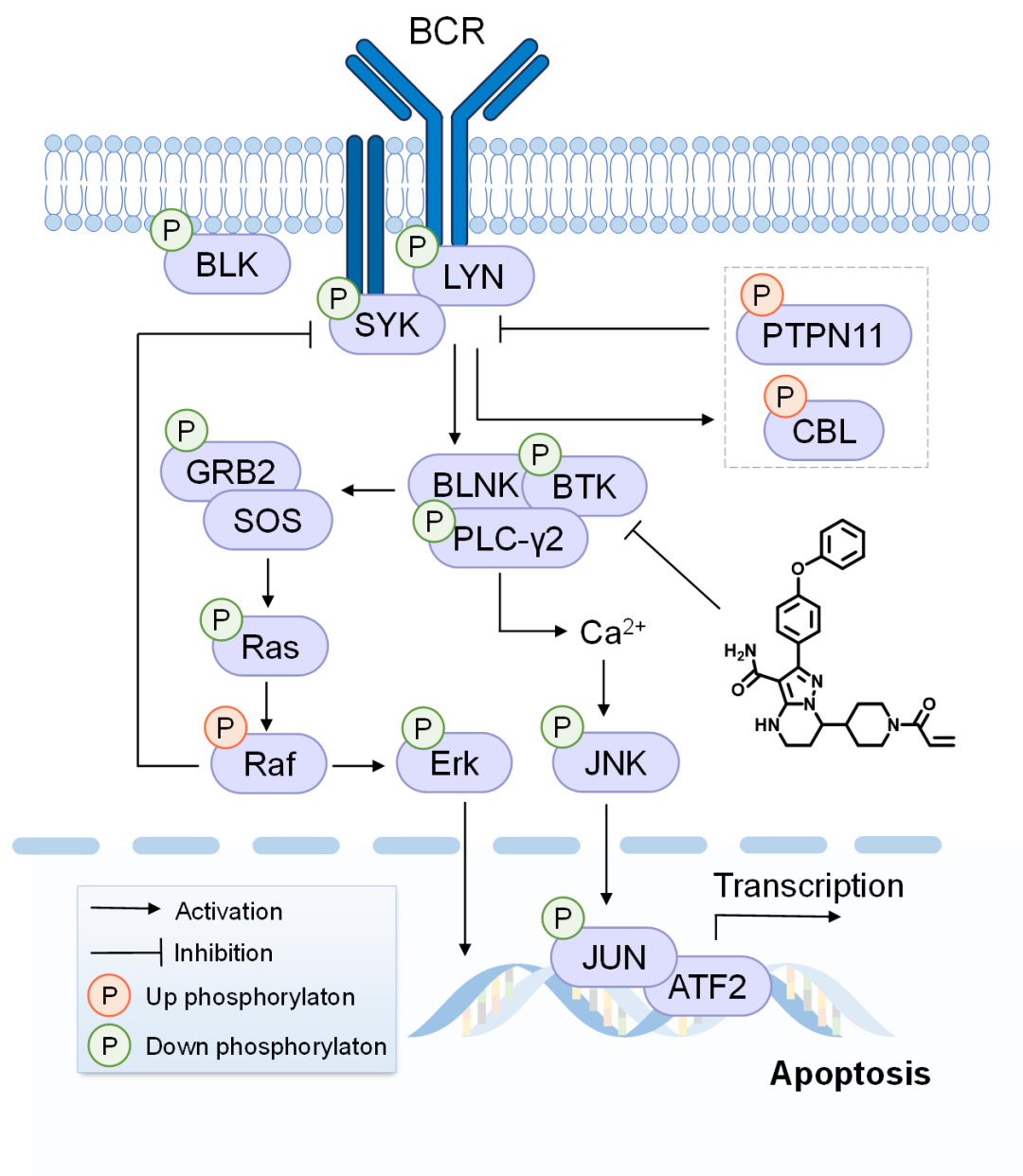
图4. 通过超深度磷酸化蛋白组学揭示的泽布替尼可能的分子药理学机制
总之,超深度磷酸化蛋白组学分析不仅能以高通量、高灵敏和高置信度的方式在细胞水平全面评价蛋白激酶抑制剂的选择性,还能通过分析药物引起的磷酸化级联反应,揭示PKI更精细的作用机理。此外,这一技术还可广泛用于细胞生物学的信号转导研究。中国科学院上海有机化学研究所博士生张越为论文第一作者,中国科学院上海有机化学研究所生物康经武研究员和上海科技大学组学分析平台的郝丕良研究员为共同通讯作者。感谢赛默飞科技有限公司在Astral分析上的帮助。该工作得到了国家自然科学基金委、中国科学院及上海市科委等项目及基金的资助。

